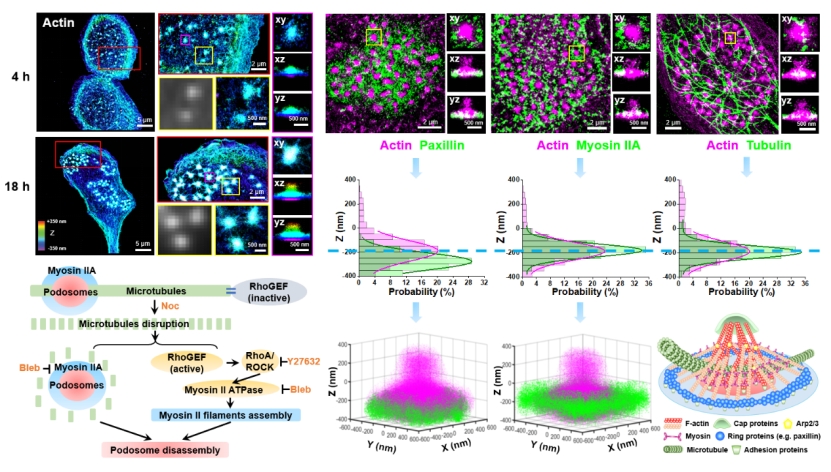
伪足小体(podosome)是一种以肌动蛋白(actin)为基础的细胞特征性动态突起结构,由数十种蛋白组成,与多种重要的生理功能如细胞粘附、细胞机械感受、细胞外基质降解等相关。许多不同类型的细胞都可以形成伪足小体结构,如血管平滑肌细胞、内皮细胞、巨噬细胞、破骨细胞和树突细胞等。近日,我院潘雷霆教授、许京军教授研究团队基于超分辨光学成像技术在巨噬细胞伪足小体簇的超微结构和调节机制方面研究获重要进展,相关成果以 “Super-resolution microscopy reveals nanoscale architecture and regulation of podosome clusters in primary macrophages”为题,发表于Cell出版集团旗下综合性刊物《iScience》(中文名称:交叉科学)。
伪足小体尺寸微小,在巨噬细胞中往往以紧密聚集的簇状超结构形式存在,常规的显微成像难以对其进行有效观察和研究。同时,该结构受到细胞微丝、微管及多种信号通路的调节,但具体机制仍未完全阐明。因此,课题组利用自主搭建的、横纵分辨率为25/50 nm的单分子定位超分辨成像系统(Single-Molecule Localization Microscopy, SMLM)研究了巨噬细胞伪足小体的三维精细结构特征和微管骨架依赖的调节机制。发现体外培养的巨噬细胞可随时间的增加逐渐形成紧密聚集的伪足小体簇超结构,并发挥基质降解功能。基于SMLM成像结果,发展了信号叠加再重构的方法,清晰地描绘出巨噬细胞单个伪足小体的三维形貌,发现其呈“雪人”形状(snowman-like structure)而非传统认为的“圆屋顶”形状(dome-like structure)。在伪足小体“核心+环”的特征性结构中,进一步揭示出“肌球蛋白(myosin)环”位于“桩蛋白(paxillin)环”上方 ~ 90 nm处,且微管骨架可于肌球蛋白环层面贯穿伪足小体肌动蛋白核心,对伪足小体簇状超结构起到物理支撑作用。微管解聚药物诺考达唑会使巨噬细胞中伪足小体解体,先前认为这一过程主要与活化Rho/ROCK/Myosin信号通路相关,本文工作表明微管的物理支撑作用在伪足小体动态调控中亦起到关键作用。研究结果将丰富伪足小体纳米尺度的结构信息,并为理解巨噬细胞中基质降解伪足小体的调控机制提供新的思路。
本文第一作者是胡芬副教授,通讯作者为潘雷霆教授,南开大学为第一作者单位。该工作得到了国家自然科学基金、中国博士后科学基金、天津市自然科学基金、南开大学细胞应答交叉科学中心等资助。
文章链接:https://www.cell.com/iscience/fulltext/S2589-0042(22)01786-2